텔로머라제(Telomerase)와 자가포식(Autophagy) part.2

안녕하세요. 텔로머라제의 모든 것을 알려드리는 텔로머라제 홍보대사입니다.
텔로미어란?
염색체 끝 부분에 붙어있는 반복 염기서열로,
염색체의 손상을 막아주는 역할을 함
텔로머라제란?
텔로미어가 손상되면 복구, 생성해주는 효소
노화를 방지하는 효소
이번 포스트에서는 이전에 포스트했던 자가포식과 텔로머라제 사이의 관계 part.1에 이어 새로운 내용을 설명드리겠습니다. 자가포식은 세포 안에서 이루어지는 재활용 시스템으로, 우리 몸에서 꼭 필요한 역할을 수행하는데요. 이전에 올린 자가포식과 텔로머라제 사이의 관계 part.1을 맨 밑에 링크 걸어둘테니 한번 보시는 것을 추천드리겠습니다.
텔로머라제와 자가포식 사이의 상관관계에 대한 논문 설명에 앞서, 자가포식이 무엇인지, 텔로머라제가 무엇인지부터 설명드리는 것이 내용 이해에 도움이 될 것 같아 먼저 간단히 알려드리겠습니다.
● 자가포식(Autophagy)

자가포식(Autophagy)은 그리스어로 스스로(auto)와 먹는다(phagy)의 뜻의 단어가 합쳐진 말입니다. 세포 내부의 물질이 세포 스스로에 의해 제거되기 때문에 붙혀진 이름이라고 하는데요. 세포질의 노폐물이나 퇴행성 단백질, 수명이 다하거나 변성돼 기능이 저하된 세포소기관들이 자가포식에 의해 제거됩니다.
제거 대상인 단백질 혹은 세포소기관은, 세포 내에서 이중막으로 된 자가포식소체(autophagosome)라고 불리는 소포 내에 격리됩니다. 이 소포는 가수분해효소가 있는 리소좀(lysosome)과 결합해 자가포식리소좀(autophagolysosome)을 형성하는데요. 이 안에서 리소좀 효소에 의해 분해가 되는 것이죠.
이렇게 분해가 이뤄진 물질들은 세포의 생존에 필요한 에너지를 만들거나 새로운 세포소기관을 생성하는데 이용됩니다. 즉, 자가포식이란 세포 안에서 이뤄지는 '재활용 시스템'이라고 할 수 있는 것이죠.
자가포식기능에 대해 알기 전에는 세포소기관의 기능이 어떤 식으로 유지되는지 몰랐다고 합니다. 자가포식 현상을 규명하면서 손상을 입거나 노화된 세포소기관은 계속 사멸-재생을 반복한다는 것을 알게 되었다고 하는데요.
자가포식에 대한 끝없는 연구로, 자가포식이 세포에 가해지는 스트레스 상황에서 대사물질을 제공하는 적응반응을 수행한다는 것이 밝혀졌습니다. 이 뿐 아니라, 종양의 발생, 종야의 성장 조절, 세포 유해 물질 제거, 대식세포에 의한 임파구로의 항원제시 에도 자가포식이 관여한다고 알려졌는데요.
이 자가포식 기능에 문제가 생기면 파킨슨병, 알츠하이머 병 등의 퇴생성 신경질환과 크론병과 같은 염증소화기 질환, 심지어 암까지 유발할 수 있다고 합니다. 즉 자가포식 기능은 우리 몸에서 꼭 필요한 기능이라고 할 수 있습니다.
● 텔로미어(Telomere)와 텔로머라제(Telomerase)

우리는 생명을 유지하기 위해 살면서 세포분열을 계속해서 진행합니다. 세포분열이 진행될 때마다 DNA(염색체)의 끝부분은 계속 짧아진다고 하는데요. 이 짧아지는 DNA 끝부분을 '텔로미어(Telomere)' 라고 합니다.
텔로미어는 non coding DNA로, 우리 몸의 유전정보를 담고 있지 않습니다. 텔로미어가 손상되도 유전 정보를 담고있는 DNA가 손상되는 것보다는 우리 몸에 큰 문제를 일으키지 않는 것이죠. 즉, 텔로미어는 유전정보가 담긴 염기서열 대신 손상되면서 염색체를 보호하는 역할을 하는 것 입니다.
하지만 계속된 세포분열로 텔로미어가 손상 될 수 있는 만큼 다 손상되고 나면, 세포분열이 더 이상 이루어지지 않게 됩니다. 세포의 노화가 시작되는 것이죠. 그래서 텔로미어 길이를 길게 유지하는 것이 우리 몸의 건강에 중요한 것 입니다. 이 텔로미어 길이가 짧아지지 않도록 유지시켜주는 효소가 우리 몸 속에 존재하는데요. 그것이 바로 '텔로머라제(Telomerase)'입니다.

텔로머라제(Telomerase)'는 텔로미어 길이를 유지시켜주는 우리 몸 속에 있는 효소입니다. 하지만 대부분의 체세포에서는 발현이 되지 않고 줄기세포, 배아세포 등 에서만 발현한다고 하는데요. 그렇다면 텔로머라제는 어떤 기전으로 텔로미어 길이를 유지시켜 주는 것 일까요?
텔로머라제는 RNA와 catalytic subunit(쉽게 말하면 효소부위)으로 이뤄져있습니다. 여기서 텔로머라제를 이루는 RNA를 TERC라고 하며, 효소부위를 TERT라고 하는데요. TERT는 Telomerase reverse transcriptase의 약자로, 텔로머라제 역전사효소를 뜻합니다.
텔로머라제 역전사효소의 기전에 대해 이전에 자세히 다룬 포스트가 있으니, 맨 밑에 링크 달아두겠습니다. 여기서는 간단하게만 설명드리겠습니다.
텔로머레이즈는 텔로미어 염기 서열과 상보결합을 갖는 RNA template를 가지고 있어, 텔로미어의 길이를 길게 해줍니다. 여기서 염기상보결합이란, A(Adenine)는 T(Thymine)과 결합하고, G(Guanine)는 C(Cytosine)와 결합하는 것을 말합니다.(A-T, G-C 결합)
만일 텔로머라제 효소의 활성화정도가 높으면 텔로미어의 길이는 거의 짧아지지 않고, 활성화정도가 낮으면 텔로미어의 손상이 보호되지 않아 텔로미어의 길이가 빠르게 짧아집니다. 즉, 노화가 빠르게 진행됩니다. 그래서 텔로머라제 효소의 활성화 정도는 우리 생명건강에 매우 중요하다고 할 수 있습니다.
여기까지 이해하셨으면 텔로머라제와 자가포식 사이의 관계를 이해하는데 어려움이 없을 것 같은데요. 이제부터 본 내용을 설명드리겠습니다.
● 텔로머라제(Telomerase) -> mTOR 활성화↓
자가포식(Autophagy)은 mTOR pathway로 조절된다고 합니다. mTOR는 영양분을 감지하는 센서역할을 하는데요. 체 내 영양분의 있는 정도에 따라 활성화 정도가 결정되는 것이죠. mTOR pathway가 활성화되면 자가포식 활동은 억제되고, mTOR pathway가 억제되면 자가포식이 활성화 된다는 기전만 알고계시면 내용 이해에 도움이 됩니다.
mTOR pathway 억제 -> 자가포식 활성화
mTOR pathway 활성화 -> 자가포식 억제
우선 영양분이 부족한 상태(Glucose starvation)에서는 자가포식 기능이 활성화됩니다. 영양분을 불필요하게 섭취하는 노화된 세포들을 제거해야 에너지 효율이 좋아지기 때문인데요. 그래서 암세포에서도 주변 세포들을 죽이고 자신이 영양분을 모두 흡수하기 위해 자가포식 활동이 활발하다고 합니다.


위 사진을 이해하기 위해서는 몇 가지 용어에 대한 개념이 필요한데요. 우선 LC3-Ⅱ는 자가포식이 되는지 여부를 알려주는 'marker' 역할을 하는 물질입니다. 즉, LC3-Ⅱ가 많을수록 자가포식이 활발한 것이지요.
LC3-Ⅱ ↑ = 자가포식 ↑
p70S6K는 mTOR의 활성화 정도를 측정하기 위해 사용했다고 하는데요. p70S6K의 인산화정도가 많을수록 mTOR가 더 활성화 되었음을 의미한다고 합니다. 즉 p70S6K의 인산화정도가 많으면 mTOR는 활성화 된 것이고, 이로 인해 자가포식은 억제됩니다.
p70S6K 인산화↑ = mTOR 활성화 = 자가포식 ↓
A 사진을 보면 hTERT(human TERT)가 발현되는 부위에서 LC3-Ⅱ가 더 많은 것을 알 수 있습니다. 즉, TERT가 발현된 곳에서 자가포식이 더 활발하다는 것이지요. 또한 p70S6K는 더 적은 것을 볼 수 있는데요. 이는 TERT가 발현된 곳의 mTOR의 활성화 정도가 TERT가 없는 곳보다 더 적다는 것을 의미합니다.
D 사진에서는 화살표가 LC3-Ⅱ를 의미하는데요. hTERT가 없는 왼쪽 보다 hTERT가 있는 오른쪽 사진에서 화살표가 있는 것을 확인할 수 있습니다. 즉, hTERT가 있는 부위에서 자가포식이 일어나는 것을 알 수 있습니다.
정리하자면, TERT가 발현되는 곳에서는 mTOR의 활성화가 떨어지고, 이로 인해 자가포식이 더 활발하다는 결론을 낼 수 있습니다.
TERT↑ -> mTORC1↓ -> autophagy↑
**mTORC1 : mTOR Complex1으로, mTOR pathway에 관여하는 complex입니다.
● (영양분 부족 시) TERT 활성화 -> 자가포식↑
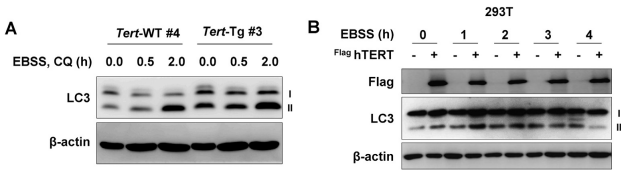
용어정리
Tert-WT : Tert가 발현하지 않은 모델
TERT-Tg : Tert가 발현한 모델
EBSS : Earle's balanced salt solution, 영양소가 들어있지 않은 염류 용액
CQ : Chloroquine, 항 말라리아, 항 아메바 약 (영양소 X)
위 사진은 MEF(Munine Embryonic Fibroblast, 쥐 배아 섬유아세포)를 각 조건에 맞게 배양했을 때 LC3가 어느정도 발현되었는지를 보여줍니다. A 사진은 EBSS와 CQ를 넣고 배양했을 때이고, B 사진은 EBSS만 넣고 배양했을 때를 의미합니다. A, B는 모두 아미노산이 없는 영양분 결핍상태입니다.
우선 EBSS만 넣고 배양한 B사진을 보면, hTERT가 있는 곳에서의 LC3양이 hTERT가 없는 곳보다 더 많은 것을 알 수 있습니다. 이는 A 사진에서 더 뚜렷하게 보이는데, TERT가 발현하는 TERT-Tg부분의 LC3양이 TERT-WT보다 훨씬 더 많은 것을 알 수있습니다.
즉, 영양소 결핍(Nutrient Deficiency)상황에서도 TERT가 자가포식을 활성화시킨다는 것을 이 실험을 통해 확인할 수 있습니다.
● TERT 결핍 -> 자가포식, 생존률↓


위에서 Tert-KO는 TERT가 발현하지 않는 모델을 의미하고, NT는 아무것도 처리하지 않은 용액을 의미합니다. A 사진을 보시면, TERT-KO에서 보다 TERT-WT에서 LC3발현이 더 높은 것을 볼 수 있습니다. 즉, TERT가 없어서 자가포식 활동이 일어나지 않았음을 확인할 수 있는 것이죠
C 그래프는 EBSS처리만 한 용액에서 TERT-KO와 TERT-WT의 MEF 생존률을 보인 것 인데요. TERT-WT에서의 생존률이 TERT-KO 보다 더 높은 것을 확인할 수 있습니다.
즉, TERT가 자가포식을 활성화시키고 생존률을 높인다는 것을 알 수 있습니다.
● 마무리
위 실험에서는 텔로머라제가 자가포식을 활성화시킨다는 결론을 내었습니다. 더 정확히 말하자면, 텔로머라제 구성 성분인 TERT가 mTOR pathway에 관여하는 mTORC1의 인산화 작용을 억제하고, 이 때문에 mTOR Pathway가 억제돼 자가포식이 활성화된다는 것인데요.
mTORC1의 과도한 활성화는 비만, 지방간, 간암 발병 위험 요소라고 합니다. 그래서 약물로 mTORC1을 차단하려는 노력들이 있었는데요. 오히려 약물로 완전히 차단하는것이 간암 발병을 더 유도할 수 있다는 부작용이 있어 많이 사용하지 않는다고 합니다.
이 때문에 mTORC1을 조절하는 방법을 찾기 위해 다양한 연구들이 진행되었는데요. TERT가 mTORC1을 조절한다는 이번 연구로, TERT를 활용한 mTORC1 조절제가 나오기를 기대해 봅니다.
최근 텔로머라제의 기능들에 대해 새로운 사실들이 밝혀지고 있는데요. 텔로머라제가 관여하는 다양한 기능들과 질병들에 대한 논문들을 블로그에 꾸준히 포스팅 할 것이니 자주 들려 새로운 내용들을 많이 알아가셨으면 좋겠습니다.
글 마지막 부분에 관련 논문 보실 수 있게 링크 걸어두었으니 더 관심있으시면 한번 보시는 것을 추천드립니다.
※논문 출처
논문 제목 : Ali, M., Devkota, S., Roh, J.-I., Lee, J., & Lee, H.-W. (2016). Telomerase reverse transcriptase induces basal and amino acid starvation-induced autophagy through mtorc1. Biochemical and Biophysical Research Communications, 478(3), 1198–1204. https://doi.org/10.1016/j.bbrc.2016.08.094

#텔로미어 #텔로머라제 #텔로머레이즈 #telomere #telomerase #자가포식 #Autophagy #mTOR # kinase #인산화 #TERC #TERT #암 #cancer #promoter #mTORpathway